2.ベンゼンに混酸を作用させてニトロ化し,ニトロベンゼンをつくる。ニトロベンゼンをスズを使って還元し,アニリンをつくる。 3.塩基性 4.アニリンより強い塩基,例えば水酸化ナトリウムの水溶液を加えると,アニリンが遊離する。 5.赤紫色ニトロアセトアニリドのパラ体を合成する実験をやった。 ただし、オルト体のものも生成するため、 途中で分離作業を要する。 手順は主に、 ニトロ化反応 1:ナスフラスコにアセトアニリドを500g程度定量し、濃硫酸11mlと混合する。この実験では、アセトアニリドのニトロ化反応を行い、続いて、ニトロアセトアニリドの加水 分解により pニトロアニリンを合成し、薄層クロマトグラフィー(TLC) で oニ トロアニリンが副生したこと

有機化学 芳香族化合物 4 3 芳香族カルボン酸 芳香族アミン 高校生 Clear
アセトアニリド ニトロ化 副生成物
アセトアニリド ニトロ化 副生成物-Dec 22, 18 · 合成 下に 4ニトロアニリンをアニリンから得る合成経路を示す。 鍵となる段階はアニリン (1) からアセチル保護したアセトアニリド (2) のアミノ基のパラ位を、混酸によりニトロ化する芳香族求核置換反応である。このとき少量生じる副生物の 2ニトロアセトアニリド (3a) を精製で除去312 アセトアニリドのニトロ化 10乾燥させた50 mLのビーカーに1)で得たアセトアニリド11をすべて入れ、濃硫酸12を加え てよくかき混ぜ2、アセトアニリドを溶解する。アセトアニリドが溶けたら、ビーカーの氷水浴に




Wo05 0905号 微生物及び微生物由来酵素によるアニリン誘導体のアセチル化 Astamuse
パラニトロアニリンの合成 ' アニリンを無水酢酸ともに加熱するとアセトアニリドができる(アセチル化 )。 +(ch3co)2o → + ch3cooh 無水酢酸 c6h5nhcoch3 § アセトアニリドをニトロ化して得られるパラニトロアセトアニリドを、加水分解して得られる12. パラニトロアニリン赤の合成と染色 目的 アゾイック染料(繊維上でカップリングさせてアゾ染料を生成させる)を用いて綿布を染色し, その原理を学ぶ. 解説 1.アゾ染料 合成染料は19世紀の中頃から作られるようになった.原料にアニリンのアセチル化の実験を通じて、試薬の調合、吸引沪過、再結晶など、有機化合物の合 成に必要な基本操作を習得する。 2 反応式 ch3c o o cch3 o h n cch3 o ho cch3 o アニリン 無水酢酸 アセトアニリド 酢酸 c c c c c c n c o o c o h h h h h h c h h c h h h h c c c c c
Sep 30, 11 · アセトアニリドの合成の実験条件とアニリンブラック (向井・小畠・大場) が過剰であるとすれば,アニリン(分子量93 3)50mlが完全に反応してアセトアニリド(分 子量 35 6)になったときの理論収量は,次式より740gと求まる。 50 × 02Dec 07, 19 · アニリンのメタ位の臭素化はニトロベンゼンの臭素化後に還元してアニリンにする方法で作ります。 その他の臭素化方法としては HBr/AlCl3(Su, Binlin et al CN , 03 Apr 13), HBr/O2, H2O2, RuCl3, Cu(OAc)2、TBA・Br3などが臭素化剤として利用されています。解決手段 連続的ジニトロ化方法は単一の装置にて 断熱性条件下に反応媒体としてのエマルジョンで行なわ れ、反応器内には芳香族化合物1モル当り1.3〜3. 5モルのHNO 3 をニトロニウム含有溶液として投入す ると共に、凝集傾向のエマルジョンを複数回の分散によ り維持する。
Dec 31, 16 · 2.アセトアニリドを15℃~℃において、混酸でニトロ化すると、モノニトロ化物として主に3ニトロアセトアニリドが生成する。 3.安息香酸を50℃~60℃において、混酸でニトロ化すると、モノニトロ化合物として主に3ニトロ安息香酸が生成する。2 ベンゼン環の配向性は電子供与性・電子吸引性で異なる 21 フェノールやアニリンは電子供与基:オルト・パラ配向性;(iii) ニトロ化 ニトロ基 ( NO 2 ) を芳香環に導入するためには、硫酸酸性条件下で硝酸 HNO 3 を作用させ、芳香族求電子置換反応を起こします。 硫酸 H 2 SO 4 ( K a ≒ 10 8 ) は、硝酸 HNO 3 ( K a ≒ 10 2 ) より強い酸であるから、硫酸中では硝酸 HNO 3 はプロトン化され、 H 2 O NO 2 を生じます。




ニトロベンゼンからアニリンを合成する語呂合わせなど 17h29大学入学共通テスト試行調査第1回第3問 問4 入試化学を語呂合わせで解く大学入試ゴロ化学




Chasing Methodologies That Are Not There 10
下に 4ニトロアニリンを アニリン から得る合成経路を示す。 鍵となる段階はアニリン (1) から アセチル 保護した アセトアニリド (2) のアミノ基のパラ位を、 混酸 により ニトロ化 する 芳香族求核置換アセトアニリド ニトロ化 反応式 Am 硝酸以外のニトロ化剤を用いるときも,と きどきその 配向が変わる。 た とえばアセトアニリドのニトロ化を ℃ の硝酸で行うとき,omp=の 比でニトロ化物を得るが,ト ルエンのときは,表1の ように,ほ ぼ一定のOニトロアセトアニリド970 (3)396 (3)396 不純物または安定化添加剤非該当 4 応急措置 吸入した場合 新鮮な空気のある場所に移すこと。 症状が続く場合には、医師に連絡すること。 皮膚に付着した場合 すぐに石鹸と大量の水で洗浄すること。




Woa1 近赤外線反射 透過性アゾ顔料 近赤外線反射 透過性アゾ顔料の製造方法 これらのアゾ顔料を用いた着色剤組成物 物品の着色方法及び着色物品 Google Patents



Ew 91回基礎完成
Nov 18, · 2.アセトアニリドを15℃~℃において、混酸でニトロ化すると、モノニトロ化物として主に3ニトロアセトアニリドが生成する。 q ニトロ化の最適温度Oct 04, 01 · 1)O- および P-ニトロアニリンの調整法として次に示した一連の反応が直接ニトロ化よりも好んで用いられる理由に ついて 2)アセトアニリドのニトロ化を0~10℃ではなく100℃でアセトアニリドのニトロ化 一般化学実験テーマ改善の試み 浅野 努 , 岡田 紀夫 , 高橋 徹 著者情報 浅野 努 大分大学工学部 岡田 紀夫 大分大学工学部 高橋 徹 大分大学文部工学部




有機化学 芳香族化合物 4 3 芳香族カルボン酸 芳香族アミン 高校生 Clear




アニリンの合成 Synthesis Of Aniline Youtube
Jun 28, 19 · pニトロアニリンの合成では、アニリンを直接ニトロ化することなく、アミノ基を保護してアセトアニリドにしてから混酸を加えてニトロ化します。ニトロ化 温度 理由 色々なレシピを見ても2合とか3号で載っています。 貯金6万 また、ニトロ化は、 60℃の温度条件 で行います! その理由は、 ニトロ系の物質は爆薬として使われます。 あまりに温度が高いと爆発します 、、、、 なので、あげすぎない実験の紹介 実験の目的とねらい 有機合成は医薬品開発の分野で役立っている。アセトアニリドはかつて解熱剤として使われたことがあり、本実験でそれを合成することにより、有機化合物の反応を身近なものとして感じることができる。




ニトロベンゼン Wikipedia




ファイル Synthesis Of Nitroaniline Svg Wikipedia
もくじ 1 芳香族求電子置換反応は場所が異なる 11 置換基による共鳴効果(r効果);(3) pアニシジンのアセチル化 (4) ニトロ化および加水分解 (成績評価の方法) 本実験は化学実験の基礎であり,実際の操作を繰り返し行うことが不可欠であるので出席を重視する.出席と実 験態度とレポートによって評価する. (コメント)製品名mニトロアセトアニリド 製品コード 製造者富士フイルム和光純薬株式会社 大阪市中央区道修町三丁目1番2号 Tel: Fax: 供給者富士フイルム和光純薬株式会社 大阪市中央区道修町三丁目1番2号




Sooh See How To Solve It At Qanda



Descubre Como Resolverlo En Qanda
そこで 「臭素化反応」の代わ りに, 同 じ 芳香族親電子置換反応 で あ る 「 か ニ ト ロ ア ニ リ ン の Nitration an of Acetanilide − An安息香酸 ニトロ化 主生成物 Sunday 2つのイオン間のサイズの差が大きいので(画像で比較)、安息香酸ナトリウム結晶の網状エネルギーが低いことは驚くべきことではない。 これは、それらの結晶が極性溶媒に可溶化したり、一連の化学反応をJPB2 JPA JPA JPB2 JP B2 JP B2 JP B2 JP A JP A JP A JP A JP A JP A JP B2 JP B2 JP B2 Authority JP Japan Prior art keywords nitric acid formula compound nitration methyl Prior art date




高校化学 ニトロ化 映像授業のtry It トライイット




メルカリ 基礎化学実験法18 参考書 600 中古や未使用のフリマ
アセトアニリドのニトロ化 濃硫酸 60 ml を 100 ml の三角フラスコにとり、アセトアニリド 25 g を加える。 発熱するので、三角フラスコを回転させながらその熱を利用してアセトアニリドを溶かす。アセトアニリド 求電子置換反応(ニトロ化)の配向性・反応性 95回薬剤師国家試験問10b 芳香族化合物に関する記述の正誤を判定してみよう。 b アセトアニリドヘの求電子的ニトロ化反応は、メタ位に比べ、オルト位及びパラ位に優先して起こる。 b アセトアニリドヘの求電子的ニトロ化反応は、メタ位に比べ、オルト位及びパラ位に優先して起こる。 既存の置換基アセトアニリドのニトロ化 一般化学実験テーマ改善の試み Nitration of Acetanilide An Attempt to Improve an Organic Experiment in General Chemistry Laboratory Course 浅野 努 ASANO Tsutomu 大分大学工学部 岡田 紀夫 OKADA Toshio 大分大学工学部 高橋 徹 TAKAHASHI Toru




Woa1 軸不斉を有するn 2 アシルアリール 2 5 7 ジヒドロ 6h ジベンゾ C E アゼピン 6 イル アセトアミド化合物及びそれを使用するa アミノ酸のキラリティ変換方法 Google Patents



84th Licence Examination
下に 4ニトロアニリンをアニリンから得る合成経路を示す。鍵となる段階はアニリン (1) からアセチル保護したアセトアニリド (2) のアミノ基のパラ位を、混酸によりニトロ化する 芳香族求核置換反応である。など意味不明な反応が多くあります。 求電子種と求核種および化学種と分子種 31 ベンゼンのニトロ化では50~60℃が最適温度で、アセトアニリドのニトロ化では15~℃が最適温度でした。この温度の違いはなぜですか?教えてください。3アニリンを直接ニトロ化したら、mニトロアニリンが得られた。(1) 反応機構を書いて選択性を説明 せよ。(ヒント:アニリンは塩基性である。酸性の試薬と出会うと何が起こるか)(2) o, p配向生成物の割 合を向上させるための合成径路を考案せよ。




02 号 クロロメチルベンゾトリアゾールの異性体を使用して腐食を禁止する方法 Astamuse




アニリン Wikipedia
Feb 06, 12 · アセトアニリドをニトロ化した時の生成物はほとんどがパラ体 (pニトロアセトアニリド)である。5 12 アセトアニリドへの求電子的ニトロ化反応は、メタ位に比べ、オルト位及びパラ 位に優先して起こる。 13 ニトロベンゼン、安息香酸、アセトフェノンはすべてメタ配向性である。 14 phenol はtoluene よりも求電子試薬との反応が速い。 15 化合物A のニトロ化を行った時、予想される主生成物FC アシル化の注意点:生成物にルイス酸が結合する C R O Al Cl Cl Cl C R OAl Cl Cl Cl H2O C R O Al(OH)3 3HCl 生成物はこの状態で存在している ・ルイス酸が消費される:1当量必要 ・ベンゼン環が不活性化されるため アシル基が2つ入ることはない 22



ベンゼン Benzennne Twitter



アセトアミノフェン Wikipedia
混酸を用いたアニリンのニトロ化 以下の問題についてです。 「混酸を用いてアニリンのニトロ化を行ったところ、反応が円滑に進行して、mおよびpニトロアニリンの混合物が得られた。この反応でmニトロアニリンが生成する理由を記せ」 アニリンは電子供与基であるため、活性的にo,p位にニトロ基が配向するはずです。




Images Of アセトアニリド Japaneseclass Jp



ニトロ化反応の条件とやり方 ネットdeカガク



公開特許公報
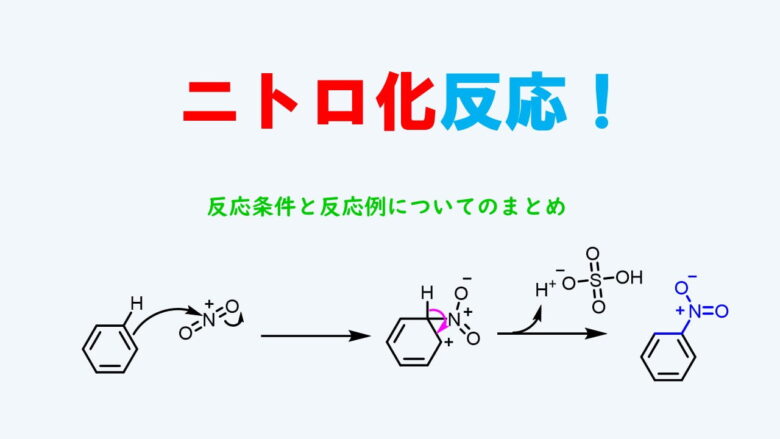



ニトロ化反応の条件とやり方 ネットdeカガク




有機化学 芳香族化合物 4 3 芳香族カルボン酸 芳香族アミン 高校生 Clear




Woa1 近赤外線反射 透過性アゾ顔料 近赤外線反射 透過性アゾ顔料の製造方法 これらのアゾ顔料を用いた着色剤組成物 物品の着色方法及び着色物品 Google Patents




第10課 芳香族化合物 2 Xmind Mind Mapping Software




Sooh See How To Solve It At Qanda




アニリン 無水酢酸 反応機構



O2 O2 O2 Descubre Como Resolverlo En Qanda



84th Licence Examination




Wo05 0905号 微生物及び微生物由来酵素によるアニリン誘導体のアセチル化 Astamuse




ニトロベンゼンからアニリンを合成する語呂合わせなど 17h29大学入学共通テスト試行調査第1回第3問 問4 入試化学を語呂合わせで解く大学入試ゴロ化学




Wo01 号 トロンボポエチン様活性を有する化合物 Astamuse




高校化学 ニトロ化 映像授業のtry It トライイット
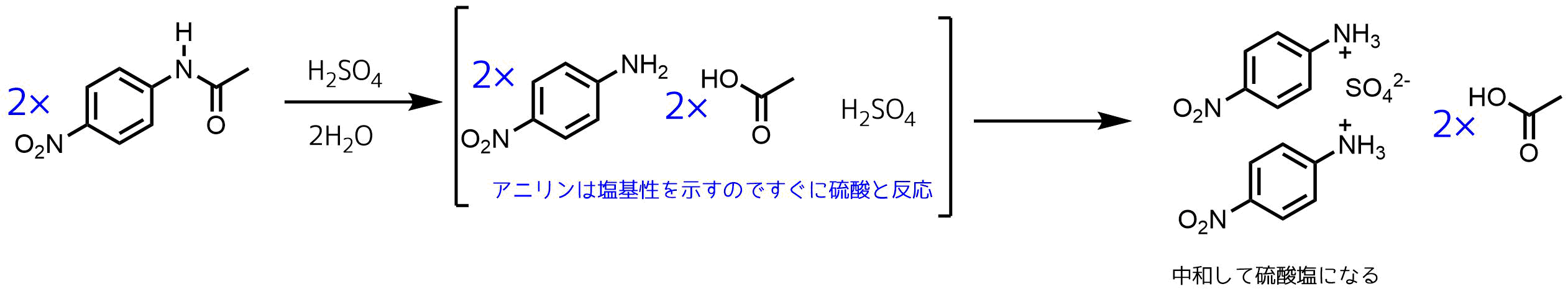



ニトロ化反応の条件とやり方 ネットdeカガク




高校化学 アニリンの製法 映像授業のtry It トライイット




P電子自由自在 C C ポリジアセチレン ナノワイヤー Fet素子 結晶工学 ナノ複合体 結晶内反応 イナミン化合物 環状化合物 Ppt Download




Wo05 0905号 微生物及び微生物由来酵素によるアニリン誘導体のアセチル化 Astamuse




1994 号 二色性染料改良剤 Astamuse



公表特許公報




薬学がわかる 薬剤師国家試験 Yakugakuatuyumi Twitter




Jpwoa1 微生物及び微生物由来酵素によるアニリン誘導体のアセチル化 Google Patents




h29センター化学第4問 問3 芳香族まとめでカップリングの語呂合わせ 入試化学を語呂合わせで解く大学入試ゴロ化学




アセトアニリドの合成 Youtube




Jpwoa1 微生物及び微生物由来酵素によるアニリン誘導体のアセチル化 Google Patents




Wo 09 A1 Method For Producing 3 Mercaptoaniline Compound Lens




02 5081号 触媒性抗体によるアルドール縮合 Astamuse




ひでと Quimica化学講師 Twitterren 化学まとめ 17 芳香族化合物 芳香族ニトロ化合物 R No ニトロ基 T Co Assl32hkgw 高校 受験 理系 化学 化学要点まとめ




3 トリフルオロメチル アニリン Wikipedia




アミド Wikipedia




アセトアニリド 合成 アセトアニリドの合成実験



Ew 91回基礎完成
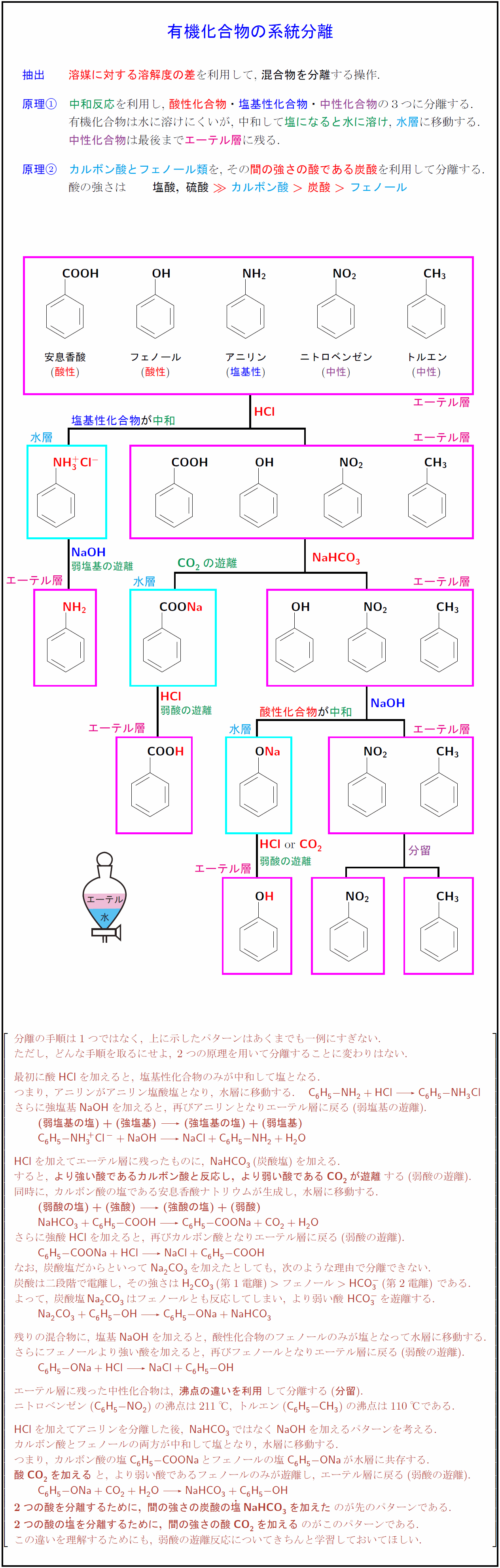



高校有機化学 芳香族化合物の系統分離の2つの原理 受験の月
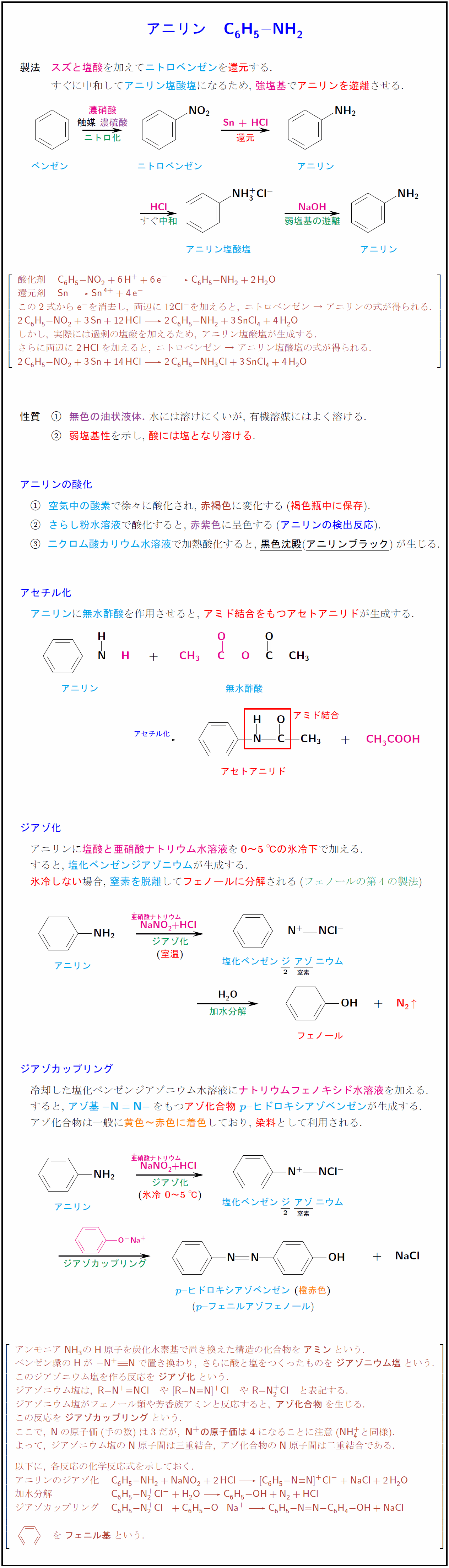



高校有機化学 アニリン C H Nh の製法 酸化 アセチル化 ジアゾ化 ジアゾカップリング 受験の月
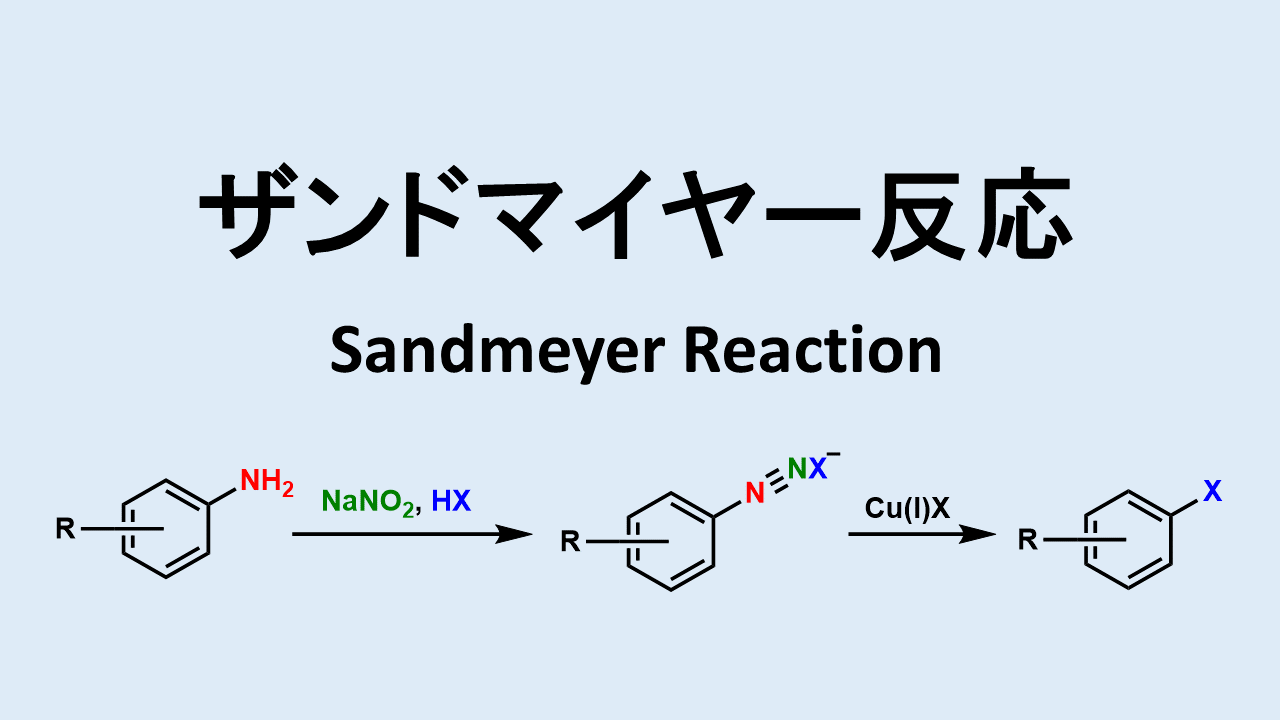



ニトロ化反応の条件とやり方 ネットdeカガク




Wo01 号 トロンボポエチン様活性を有する化合物 Astamuse




2 ニトロアニリン Wikipedia




サルファ剤合成 Step3 アニリンのアセチル化 アセトアニリドの合成 Synthesis Of Acetanilide Youtube



Hso Barsohdfrac Na014n Sumn See How To Solve It At Qanda
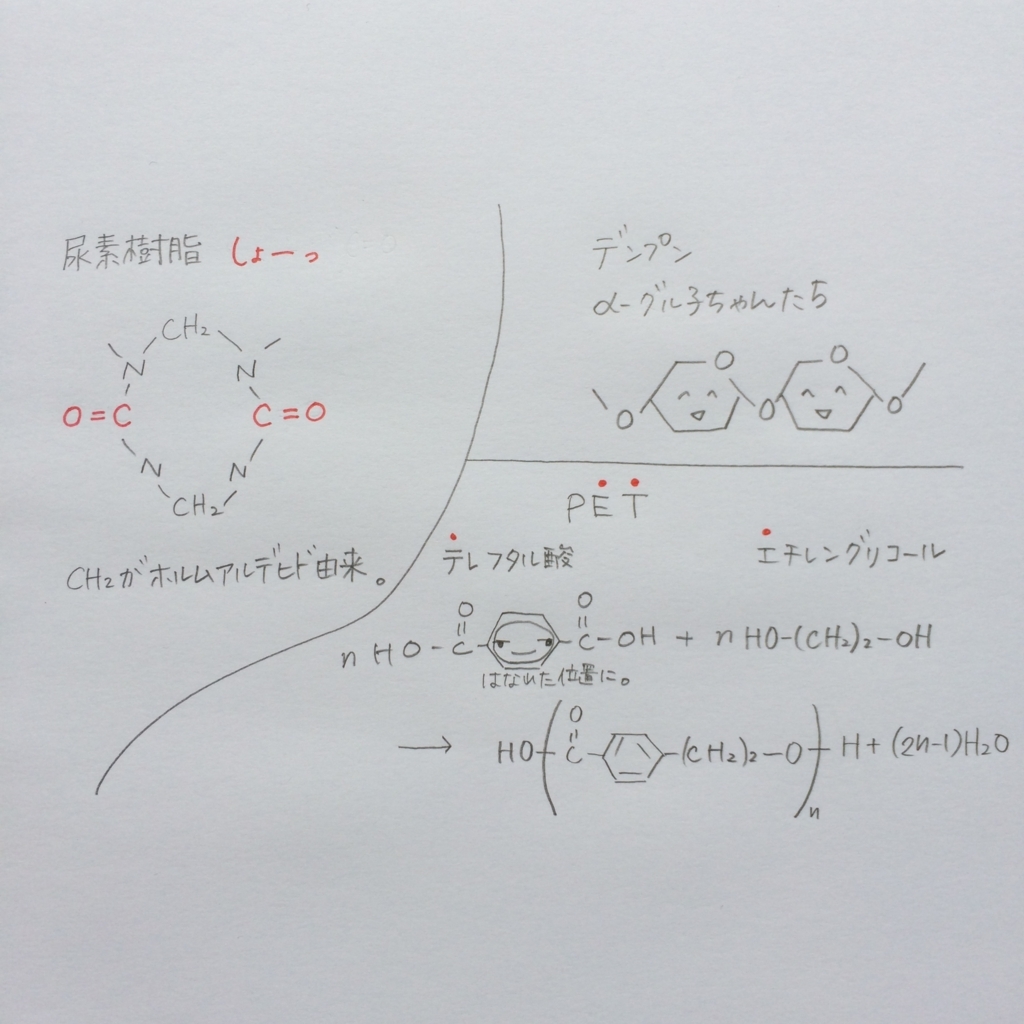



h29センター化学第5問 問1 ナイロン6と熱硬化性樹脂の語呂合わせ 入試化学を語呂合わせで解く大学入試ゴロ化学




高校化学 ジアゾ化 映像授業のtry It トライイット




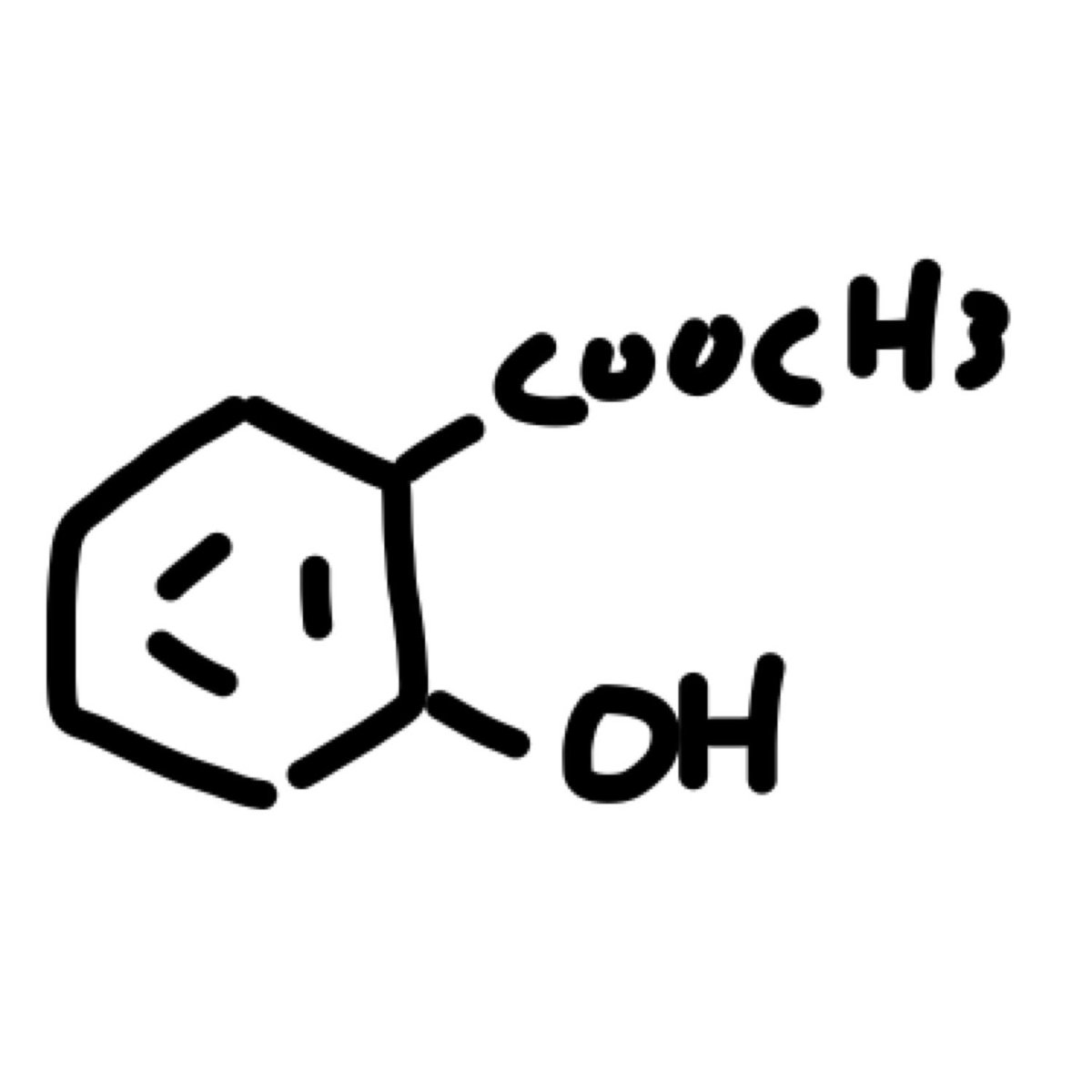
4942 Ycoochs Byzhcochs Cc Lihat Cara Penyelesaian Di Qanda



84th Licence Examination




ニトロ化反応の条件とやり方 ネットdeカガク




Images Of アセトアニリド Japaneseclass Jp
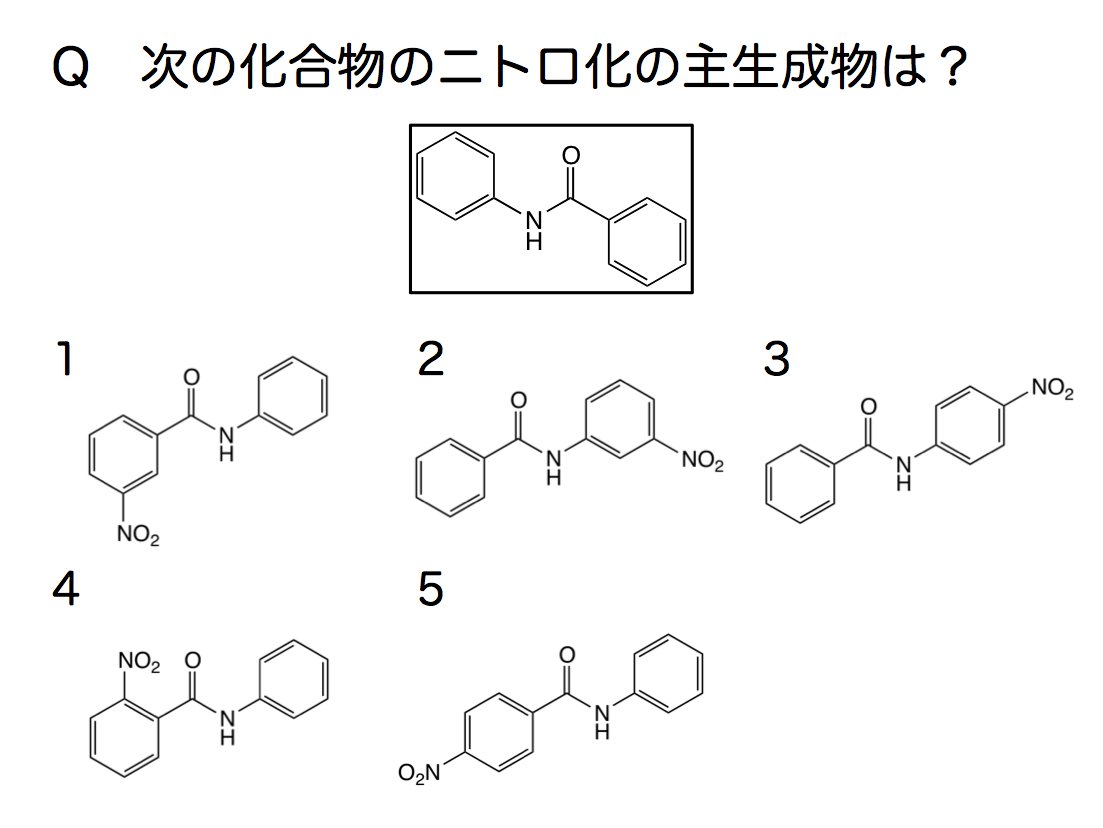



カロフィコ 𝐀𝐳𝐮𝐫𝐛𝐥𝐚𝐮 学生実験でお馴染みのアニリンからp ニトロアニリンを作るときのアセトアニリドの ニトロ化と同じようにできるでしょう もちろん反応熱で温度が上がりすぎてしまうとジニトロ体が生じたり 脱アシル化でアニリンになっての




Woa1 植物成長調整剤 Google Patents
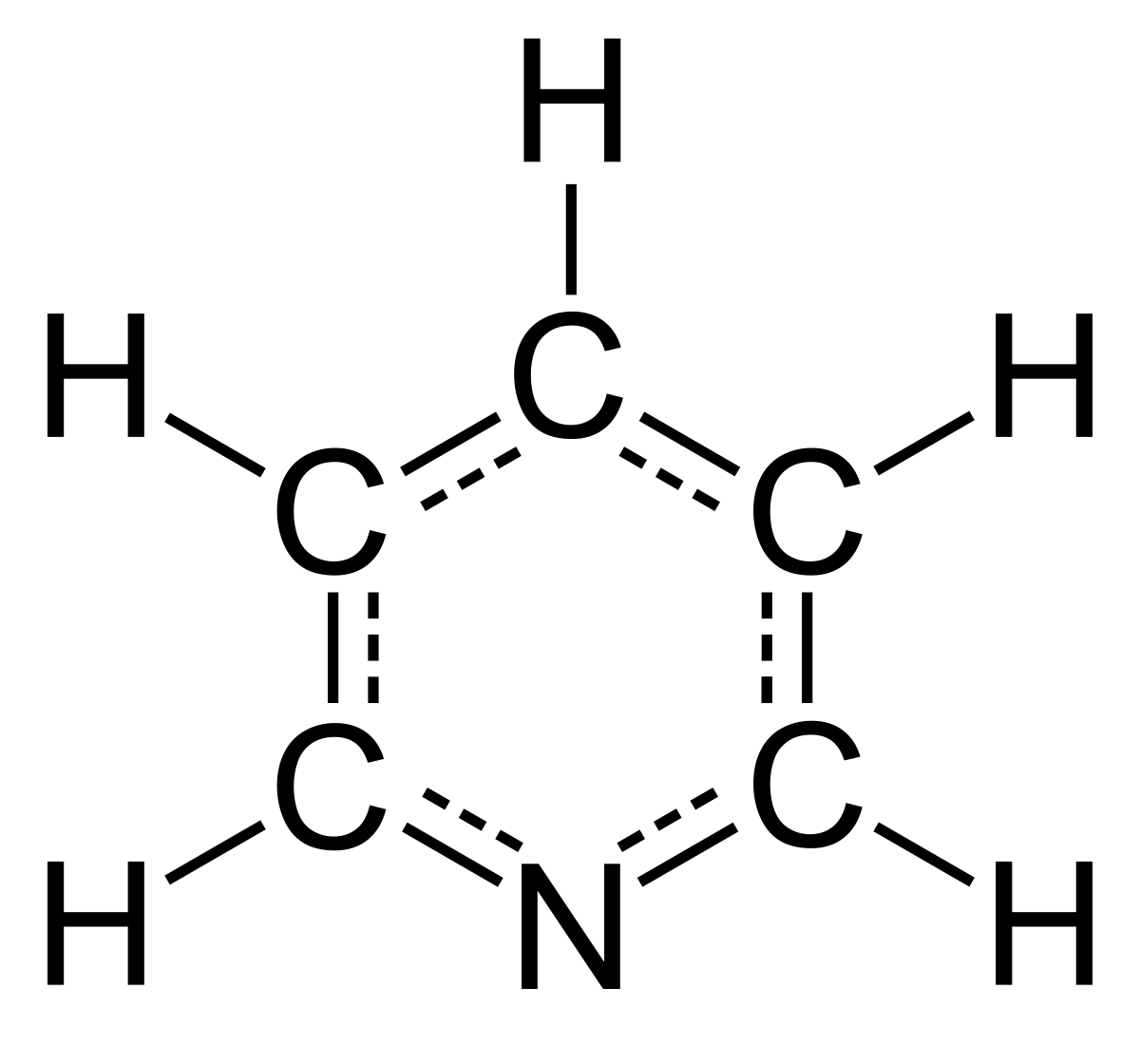



ピリジン Wikipedia




Wo 09 A1 Method For Producing 3 Mercaptoaniline Compound Lens




サルファ剤合成 Step3 アニリンのアセチル化 アセトアニリドの合成 Synthesis Of Acetanilide Youtube




Wo 09 A1 Method For Producing 3 Mercaptoaniline Compound Lens



公開特許公報




高校化学 有機化合物 テスト13 第1問 問題編1 映像授業のtry It トライイット
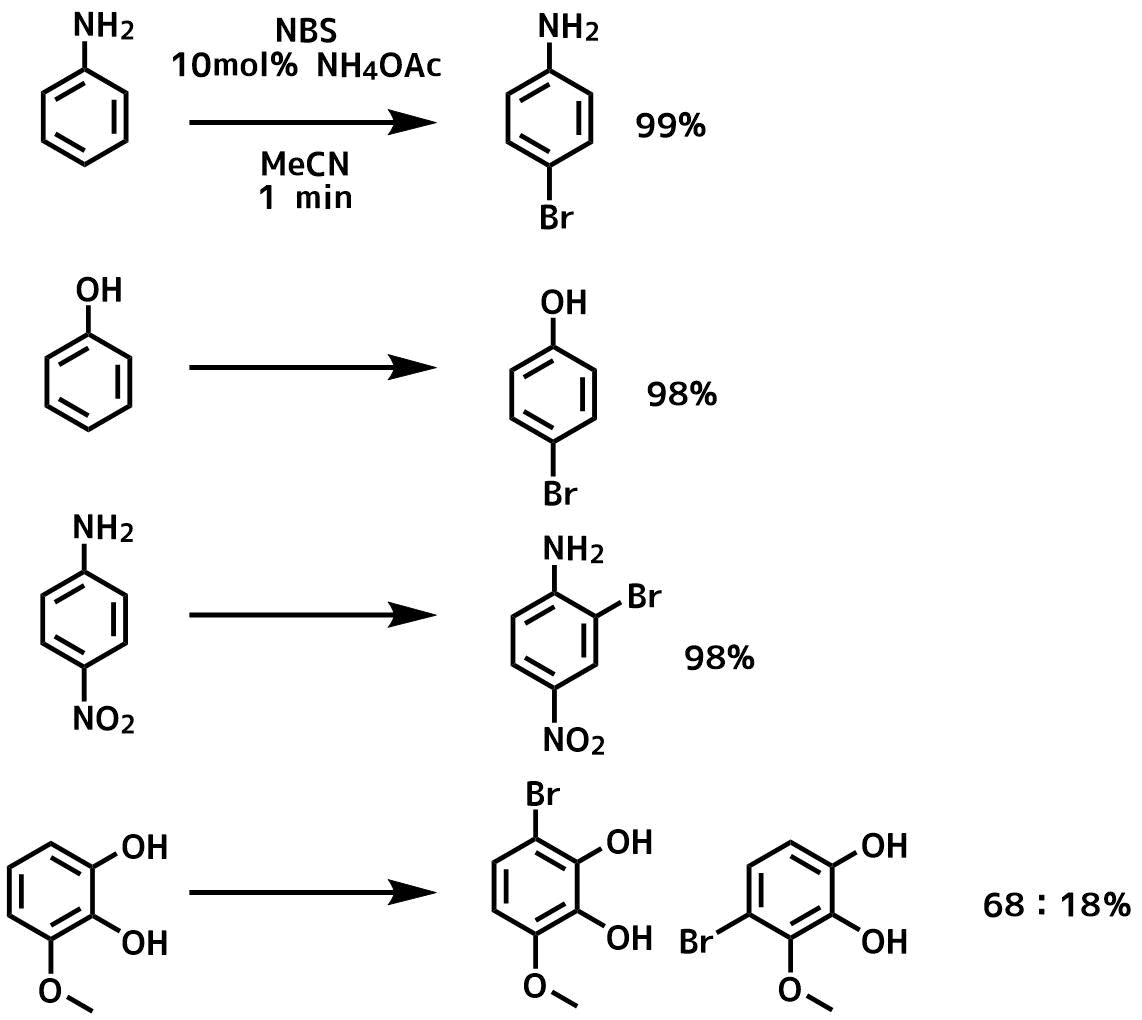



芳香環の臭素化 ネットdeカガク




Wo05 0905号 微生物及び微生物由来酵素によるアニリン誘導体のアセチル化 Astamuse



0 件のコメント:
コメントを投稿